La neutralisation consiste à corriger le taux pH d’un effluent vers une valeur dite neutre, soit entre pH7 et pH8. (on parle de correction du pH ou de neutralisation du pH) En France et en Europe, la loi sur l’eau impose que les effluents rejetés au milieu ou au réseau aient un pH compris entre 7 et 8.
Sur des effluents dont le pH est très alcalin (ou basique) supérieur à pH8,5 ; la correction vers un pH neutre va nécessiter l’apport ou la création dans l’effluent à corriger d’une solution acide. Inversement sur des effluents dont le pH est acide (pH inférieur à 6) la neutralisation va nécessiter l’apport d’une solution basique (soude ou lait de chaux).
LE DIOXYDE DE CARBONE (CO2)
Le dioxyde de carbone plus connu sous son appellation générique gaz carbonique ou encore « CO2 » est un gaz neutre et non corrosif, naturellement présent dans l’atmosphère terrestre, il participe activement à l’alchimie de la vie à travers le phénomène de photosynthèse. Ses utilisations sont multiples, pour exemples : anti-feu, culture sous serre, emballage à atmosphère contrôlée, conservation de denrées périssables, aquariophilie, industrie des boissons, neutralisation des effluents. Facile à stocker et à manutentionner le dioxyde de carbone est produit et commercialisé par des groupes industriels traitants des gaz de l’air. Il se présente en bouteille ou en citerne sous phase liquide et est utilisé essentiellement sous phase gazeuse.
LA NEUTRALISATION D’UN EFFLUENT AU DIOXYDE DE CARBONE (CO2)
(un procédé écologique)
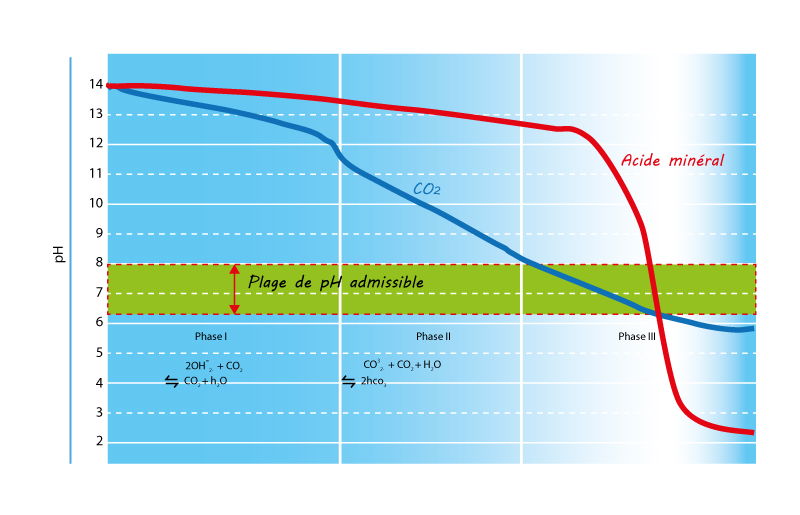
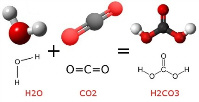 Au contact de l’eau - et sous certaines conditions de pression et de T°-, le gaz carbonique se dissout et se transforme en acide carbonique H2CO3. L’acide carbonique dissous dans une solution à pH neutre est instable car il a tendance à se déshydrater plus ou moins rapidement selon la température ambiante, pour finir par se (re) décomposer en CO2 et H2O. Par contre, lorsque le CO2 est dissout dans une solution basique (pH supérieur à 8), la solubilité est considérablement augmentée et l’acide carbonique (H2CO3) généré particulièrement stable. Cette stabilité va permettre au processus de correction du pH de se réaliser dans des conditions optimales : en effet, l'acide carbonique (H2CO3), a des propriétés diacide et, dans un milieu à pH fort il va se dissocier deux fois de suite en libérant à chaque fois un proton H+ : c’est la phase de déprotonation. Ce principe de libération va se perpétuer jusqu’à l’obtention d’un seuil de pH neutre.
Au contact de l’eau - et sous certaines conditions de pression et de T°-, le gaz carbonique se dissout et se transforme en acide carbonique H2CO3. L’acide carbonique dissous dans une solution à pH neutre est instable car il a tendance à se déshydrater plus ou moins rapidement selon la température ambiante, pour finir par se (re) décomposer en CO2 et H2O. Par contre, lorsque le CO2 est dissout dans une solution basique (pH supérieur à 8), la solubilité est considérablement augmentée et l’acide carbonique (H2CO3) généré particulièrement stable. Cette stabilité va permettre au processus de correction du pH de se réaliser dans des conditions optimales : en effet, l'acide carbonique (H2CO3), a des propriétés diacide et, dans un milieu à pH fort il va se dissocier deux fois de suite en libérant à chaque fois un proton H+ : c’est la phase de déprotonation. Ce principe de libération va se perpétuer jusqu’à l’obtention d’un seuil de pH neutre.
C’est grâce à ce principe chimique d’équilibre que le CO2 :
- permet une régulation précise du pH
- évite les risques de suracidification
- prévient de toute pollution secondaire saline et organique due aux chlorures et sulfates
La courbe ci après démontre l’avantage d’un processus de neutralisation au CO2 par rapport à un processus utilisant un acide minéral.